导读:Cytori
Therapeutics公司(纳斯达克代码:CYTX)宣布BARDA(美国生物医学高级研究和发展管理局)资助的使用Cytori细胞疗法™治疗纤维化瘢痕形成模型的临床前研究数据正式发表在《Stem
Cell Research and
Therapy》杂志上,IF=4.211。这项研究是在BARDA的支持下进行的,作为美国FDA批准的RELIEF试验的临床前研究数据的组成部分[1]。

该研究描述了Cytori细胞疗法™的活性成分脂肪来源的再生细胞(ADRCs),被注入到增生性疤痕的临床前研究的金标准动物–猪的深部部分创面模型。治疗6个月后,用ADRCs治疗的伤口与对照组的伤口相比,增生性瘢痕的指标显著减少。改善的指标包括皮肤硬度、组织、血管分布和表皮变化。结果分析表明白细胞介素IL-6表达水平在受伤后2周上调,而在治疗4周显著降低,这说明IL-6作为炎症反应的关键调节器,起到潜在的作用。
试验过程和结果
1. ADRCs的分离和鉴定
使用Celution系统从猪的腹股沟脂肪组织中自动分离脂肪来源的再生细胞(ADRCs)。Celution系统从每克脂肪组织中分离出的ADRCs细胞平均数量为1.65×106±0.4×106个 (范围: 1.2×106-2.2×106个细胞/每克脂肪组织);平均细胞活性为97.2%±0.4%(从96.7%到97.6%不等)。流式细胞检测分析ADRCs的细胞组成(图1):
(1)白细胞(CD45+)平均占比为9.8%;
(2)内皮细胞(CD31 +/CD45–)的平均占比为5.7%;
(3)基质细胞CD90+/CD45–:成纤维细胞和成纤维样细胞) 平均占比68.9%;(4)平滑肌相关细胞(壁细胞;CD31–/CD146+/CD45–)占26.1%左右;
(5)CFU-F分析表明基质血管祖细胞/干细胞平均占比为4.8%(图2);
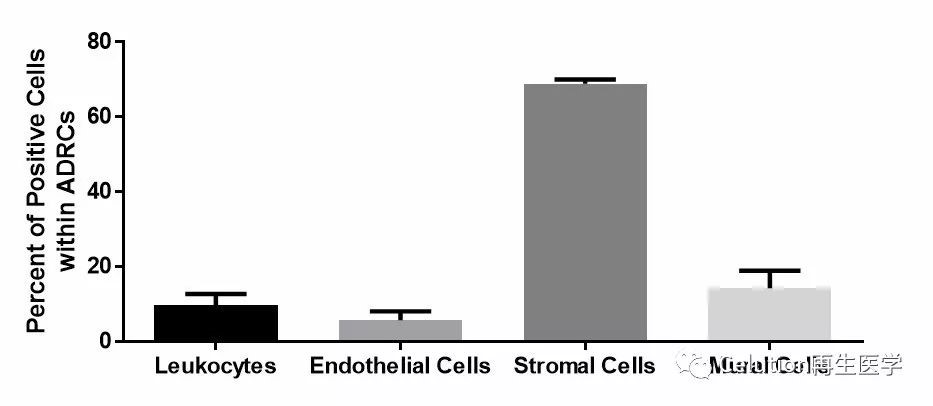
图1:流式细胞检测分析ADRCs组分
图2:成纤维细胞样集落形成单位测定(CFU-F)ADRCs中的基质祖细胞/干细胞
2. ADRCs移植减少了疤痕组织的硬度
使用2种非侵入性设备(硬度计和纤维分析计)对ADRCs移植后每个伤口的皮肤硬度2月和6月的结果进行分析。硬度计的检测数据表明:ADRCs治疗组的伤口皮肤硬度减少了10~20%(图3a):
(1) 2个月结果: ADRCs治疗组:对照组=33±2.3和42.5±1.9,p < 0.05;
(2) 6个月结果: ADRCs治疗组:对照组=33.2±2.6和38.3±2.6,p < 0.05;
纤维计检测结果显示了同样的规律(图3b):
(1) 2个月结果:ADRCs治疗组:对照组=0.34±0.04:0.47±0.04 N, p < 0.05;
(2) 6个月结果:ADRCs治疗组:对照组=0.54±0.03 vs 0.6±0.04 N, p = 0.08。
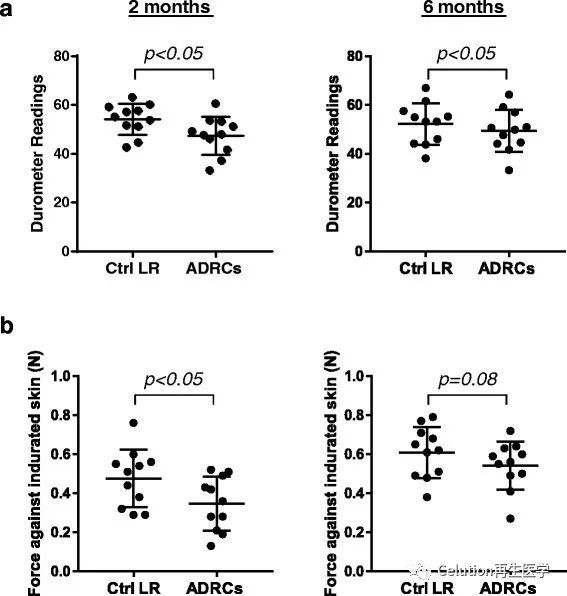
图3 a)硬度计测量ADRCs治疗2月和6月的组织硬度;
b)纤维计测量ADRCs治疗2月和6月的组织硬度;
3. ADRC移植促进了表皮重构
表皮突减少引起了表皮的平整[2,3],在固定表皮到健康皮肤真皮起到了关键作用,这是增生性瘢痕的一个特点;定量分析治疗组和对照组的表皮突的频率,ADRCs治疗组比对照组平均大48%(图4a,4b):
ADRCs治疗组:对照组=5.2±1.4:3.5±1.4(mm),p<0.01;
4. ADRC移植改善了胶原沉积
胶原定位和胶原束形态异常是增生性瘢痕的标志[3,4]。最常规的胶原蛋白结构分析标准是胶原蛋白的方向和厚度。在人体的增生性瘢痕(hyperplastic
scar,
HTS)中,胶原蛋白是与表皮平行的密集排列的离散薄纤维束。为了研究ADRCs在胶原组织形成中的作用,我们对损伤部位治疗6月进行活体的组织化学染色。对照组的损伤部位的胶原纤维密集排列且平行于表皮方向。ADRCs治疗组的损伤部位显示出更厚的厚度和束间距(图4c)。
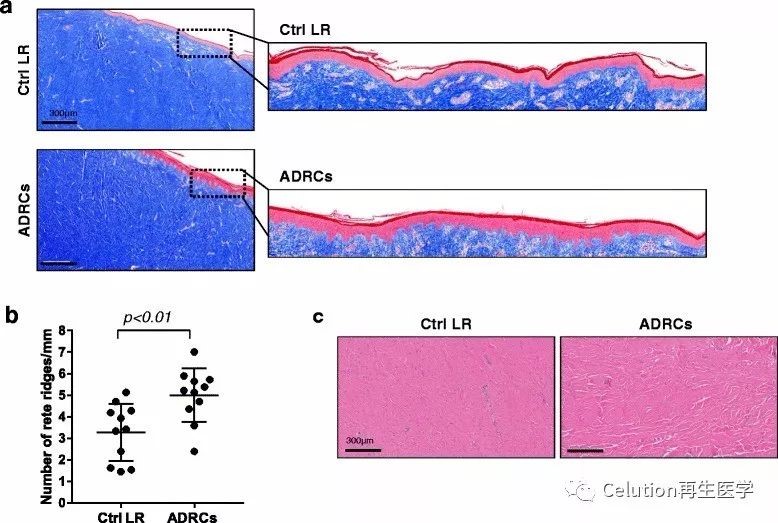
图4 ADRCs在胶原蛋白组织和表皮成熟过程中的作用;
a)Masson三色染色法对损伤组织接受ADRCs治疗后6月进行活检,CtrlLR为对照组,ADRCs为治疗组;
b)ADRCs治疗组和对照组损伤部位的表皮突数量;
c)对损伤部位进行H&E染色处理后,ADRCs治疗组和对照组的胶原蛋白组织。
5. ADRCs移植降低了瘢痕组织的血管化形成
增生性瘢痕往往伴随着血管数量的增多[5]。为了评估ADRCs在瘢痕组织微血管密度的作用,对治疗后6个月的损伤部位进行组织切片免疫化学活检分析,使用一个公认的血管壁平滑肌组织标记α-SMA。数字定量结果显示显示ADRC治疗组的微血管密度(MVD)比对照组低了27%:
ADRCs治疗组:对照组=17.6±4.7:24.4±6mm2,p< 0.05 (图5);

图5 ADRCs对瘢痕血管化的作用
a)对照组和治疗组伤口部位治疗6个月后的活检组织α-SMA的染色分析;
b)自动化量化分析对照组和治疗组损伤部位的微血管密度;
6. ADRCs移植增加了弹性纤维的长度
弹性纤维是皮肤的重要的组成部分,在增生性瘢痕组织中往往非常少[6]。为了研究ADRCs对弹性纤维再生的作用,收集治疗后的6个月时的标本进行VVG染色。与对照组相比,ADRC治疗组的平均弹性纤维长度显著增加 (约23%,图6):
ADRCs治疗组:对照组=43.9±5.4:35.5±5.8 μm,p < 0.05。

图5 ADRCs对弹性纤维长度的影响a)治疗6月后,对照组和治疗组的活体组织VVG染色分析;
b)Aperio Image Scope分析对照组和ADRCs治疗组弹性纤维的长度;
7. ADRCs移植调控炎症反应
增生性瘢痕形成过程伴随着炎症反应的解除和破坏[7,8]。为了进一步研究ADRCs在损伤愈合和HTS形成中的炎症反应过程。我们研究了损伤愈合阶段(受伤后2周)和增生性瘢痕早起形成阶段(受伤后2月)的IL-6,TNF-α和IL-10的细胞因子的数量水平。
治疗后2周,ADRCs治疗组的伤口表现出更高的IL-6(是对照组的2.7倍,p < 0.05)和TNF-α(1.5倍;p =
0.06)表达水平;治疗后2月,ADRCs治疗组的细胞因子IL-6水平比治疗组更低 (4.5倍; p =
0.06),TNF-α水平在ADRCs治疗组和对照组的伤口之间没有显著差异 (图7)。在ADRCs治疗组和对照组均未检测到IL-10的表达。
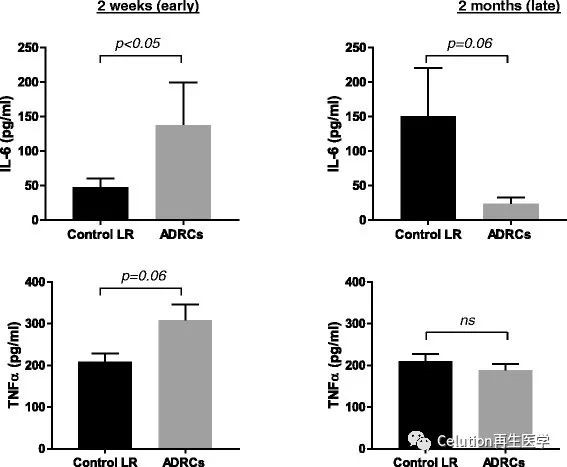
图7 ADRCs对伤口及早期瘢痕验证反应的影作用。治疗2周后,ADRCs治疗组和对照组TNF-α和IL- 6水平;使用猪特异性蛋白酶联免疫吸附测定(ELISA)试剂盒提取和溶解IL-6和TNF-α蛋白。
8. 试验总结
• ADRCs治疗组损伤部位表皮突的频率显著增加。表皮突在将表皮固定在真皮上起到关键作用,帮助表皮免受剪切力引起的损伤。
• ADRCs治疗组的损伤部位表现出更正常的血管性,更正常排列的胶原蛋白束,更长的弹性纤维。
• ADRCs移植在促进损伤愈合时调控了许多个增生性瘢痕的表征。
• 本研究拓宽了我们之前的工作且表明ADRC的治疗不仅仅是简单的改进了上皮化过程,而且可以的长期改善瘢痕和皮肤功能。
研究价值
本临床前研究结果被纳入到BARDA赞助的基于Cytori细胞疗法™的RELIEF临床试验。RELIEF试验将评估Cytori细胞疗法治疗人体的大量热烧伤损伤的情况。除了对早期治疗的评估外,通过类似于本研究中应用的方法,RELIEF试验将评估几个与瘢痕相关的指标参数。“纤维化是烧伤和硬皮病的常见表现“。Cytori首席科学家约翰·弗雷泽博士说。“这一临床前研究与许多新兴研究一致,表明Cytori的ADRC技术在纤维化疾病中的有益作用。”
热烧伤的治疗仍然是一个关键的未满足的医疗需求。尽管护理标准主要包括敷料、皮肤移植和皮肤替代品,但患者经常遭受疼痛、瘢痕、皮肤挛缩和受限制的运动范围。增生性瘢痕的特点是生长、变色、瘙痒和疼痛,这是深厚度烧伤引起的常见的纤维化结果。
由Cytori提供的自体细胞疗法在提高创面愈合的质量、康复速度和减少疤痕方面具有潜力。在大规模的伤亡事件中,美国政府问责办公室预测多达1万名患者可能需要热烧伤护理。
在美国,仅仅有限数量的专科医生和烧伤中心为烧伤创面提供了公共卫生需求,而Cytori细胞疗法可以迅速并广泛应用于此类事件后由非专科医疗人员进行广泛应用。
因此,Cytori的自体细胞治疗是一种新的医学技术手段,不仅能促进创面愈合和组织修复,改善伤者护理;同时,也可以应用于解决大规模伤亡事件中遇到的挑战,
关于RELIEF试验
RELIEF试验将评估经静脉注射的Cytori细胞疗法™作为常规治疗的辅助方法,在治疗那些热烧伤覆盖身体表面积的20%和50%之间的患者安全性和可行性。
受试者将至少有一个深度部分或全部的厚度烧伤创面,以配合自体裂开厚度皮肤移植(STSG)。受试者将随机(1:2)接受通常的护理,或通常的护理补充Cytori细胞治疗。
在主要评估安全性和可行性的同时,RELIE试验还将评估一系列与皮肤移植愈合相关的参数。这项试验被批准在美国境内的10个临床试验机构共计入组30名患者,预计该研究将于近期启动。
关于Cytori
Cytori是一家聚焦于再生医学和肿瘤疗法研发的治疗学公司,基于其专有的细胞疗法和纳米粒子平台开发再生和肿瘤疗法,以用于解决不同的医疗需求。
临床前研究和临床试验的数据表明,Cytori细胞疗法™机理主要是通过改善血液循环、调节免疫系统,促进伤口修复来实现的。因此,Cytori细胞疗法™能够为不同种类的疾病的提供治疗选择,可以提供给医生和病人在现阶段通过Cytori公司的专有技术和产品。
关于络仁医疗
络仁医疗创立于2013年,公司致力于打造再生医学旗舰平台,总部设于新加坡,在中国大陆、香港、澳大利亚和马来西亚设有子公司。络仁医疗与国际领先的再生医学医疗机构及研究所建立战略合作关系,公司聚焦于推动再生医学治疗技术在慢性疾病、血管类疾病、免疫系统疾病及部分罕见疾病的临床治疗和应用,从而提高医生应对上述病症的方法和手段,改善病患生存品质,为全人类的健康和幸福而努力。如您想了解更多信息,请访问www.loremvascular.cn.
参考文献:
1. Foubert, et al. (2017). Autologous adipose-derived regenerative
celltherapy modulates development of hypertrophic scarring in a red
Duroc porcinemodel. Stem Cell Research & Therapy. 8. 261.
10.1186/s13287-017-0704-1.
2. Harunari N, et al. Histology of the thick scar on thefemale, red
Duroc pig: final similarities to human
hypertrophicscar. Burns. 2006;32:669–677. doi:
10.1016/j.burns.2006.03.015.
3. Gauglitz GG, et al. Hypertrophic scarring and keloids:pathomechanisms
and current and emerging treatmentstrategies. Mol Med. 2011;17:113–125.
doi: 10.2119/molmed.2009.00153.
4. Finnerty CC, et al. Hypertrophic scarring: the greatest unmet
challengeafter burn
injury. Lancet. 2016;388:1427–1436.doi:10.1016/S0140-6736(16)31406-4.
5. Xie Y , et al. The microvasculature in cutaneous wound healing inthe
female red duroc pig is similar to that in human hypertrophic scars
anddifferent from that in the female Yorkshire pig. J Burn Care
Res.2007;28:500–506. doi: 10.1097/BCR.0B013E318053DAFE.
6. Eckes B, et al. Cell-matrix interactions in dermal repair
andscarring. Fibrogenesis Tissue Repair. 2010;3:4. doi:
10.1186/1755-1536-3-4.
7. van der Veer WM, etal. Potential cellular and molecular causes of
hypertrophicscar formation. Burns. 2009;35:15–29.
doi:10.1016/j.burns.2008.06.020.
8. Qian LW, et al. Exacerbated and prolonged inflammation impairs
woundhealing and increases scarring. Wound Repair Regen. 2016;24:26–34.
doi:10.1111/wrr.12381.
非常感谢您对络仁医疗的支持和关注!

 微信公众平台
微信公众平台